Le glaucome représente l’une des causes principales de cécité dans le monde, touchant plus d’un million de personnes en France. Cette pathologie oculaire insidieuse se caractérise par une dégénérescence progressive du nerf optique, souvent associée à une élévation anormale de la pression intraoculaire . La particularité du glaucome réside dans son évolution silencieuse : pendant des années, cette maladie peut progresser sans manifester de symptômes perceptibles, d’où son surnom de « voleur silencieux de la vue ». Reconnaître précocement les signes avant-coureurs constitue un enjeu majeur de santé publique, car les dommages causés au nerf optique sont irréversibles. Une détection rapide permet cependant de ralentir, voire d’arrêter la progression de la maladie grâce aux traitements actuels.
Anatomie de l’œil et mécanismes physiopathologiques du glaucome
Pour comprendre les manifestations du glaucome, il convient d’abord d’examiner l’architecture complexe de l’œil et les mécanismes qui régissent sa fonction. L’œil fonctionne comme un appareil photographique sophistiqué, où chaque structure joue un rôle précis dans la transmission des informations visuelles au cerveau.
Rôle de l’humeur aqueuse dans la régulation de la pression intraoculaire
L’humeur aqueuse constitue un élément fondamental dans la physiopathologie du glaucome. Ce liquide transparent, produit continuellement par les procès ciliaires, remplit la chambre antérieure de l’œil et nourrit les structures oculaires dépourvues de vascularisation, notamment la cornée et le cristallin. La production d’humeur aqueuse représente environ 1% du volume total de ce liquide par minute, soit approximativement 2 à 3 microlitres.
Ce renouvellement constant nécessite un équilibre délicat entre production et élimination. L’humeur aqueuse circule depuis les procès ciliaires vers l’angle iridocornéen, où elle est évacuée principalement à travers le trabéculum. Toute perturbation de cet équilibre entraîne une modification de la pression intraoculaire, normale entre 10 et 21 mmHg. Lorsque l’évacuation devient insuffisante par rapport à la production, la pression augmente progressivement, créant les conditions favorables au développement d’un glaucome.
Dysfonctionnement du trabéculum et angle iridocornéen
Le trabéculum fonctionne comme un filtre biologique sophistiqué, régulant l’écoulement de l’humeur aqueuse hors de l’œil. Cette structure spongieuse, située dans l’angle iridocornéen, présente une architecture particulière avec des espaces intercellulaires qui permettent le passage du liquide intraoculaire vers le système de drainage épiscléral.
Dans le glaucome chronique à angle ouvert, le trabéculum subit une dégénérescence progressive . Les cellules trabéculaires accumulent des dépôts extracellulaires, réduisant la perméabilité du filtre. Cette obstruction partielle mais croissante entraîne une résistance accrue à l’écoulement de l’humeur aqueuse. Parallèlement, l’angle iridocornéen peut présenter des modifications anatomiques subtiles qui aggravent le dysfonctionnement du drainage oculaire.
Atteinte du nerf optique et excavation papillaire progressive
Le nerf optique, composé d’environ un million de fibres nerveuses, constitue la cible principale des dommages glaucomateux. Ces fibres, prolongements des cellules ganglionnaires rétiniennes, convergent vers la papille optique pour former le nerf optique proprement dit. La papille optique présente normalement une excavation physiologique centrale, appelée cup, entourée d’un anneau neurorétinier où passent les fibres optiques.
L’élévation de la pression intraoculaire exerce une contrainte mécanique sur les fibres les plus vulnérables, situées à la périphérie de la papille. Cette compression chronique déclenche des mécanismes d’apoptose cellulaire, entraînant la mort progressive des cellules ganglionnaires. L’excavation papillaire s’agrandit alors de manière caractéristique, avec un amincissement de l’anneau neurorétinier. Ce processus dégénératif explique l’apparition des déficits du champ visuel typiques du glaucome.
Classification selon les mécanismes : glaucome à angle ouvert versus angle fermé
La classification physiopathologique du glaucome distingue principalement deux mécanismes : l’angle ouvert et l’angle fermé. Cette distinction revêt une importance capitale pour comprendre la symptomatologie et orienter la prise en charge thérapeutique.
Le glaucome à angle ouvert, représentant 90% des cas, se caractérise par un angle iridocornéen anatomiquement normal mais fonctionnellement défaillant. Le trabéculum reste accessible mais perd progressivement sa capacité filtrante. À l’inverse, le glaucome à angle fermé résulte d’un blocage mécanique de l’accès au trabéculum, généralement par contact entre l’iris périphérique et la cornée. Cette fermeture peut être partielle et progressive, ou brutale et complète dans le cas du glaucome aigu. Les conséquences hémodynamiques et cliniques diffèrent radicalement entre ces deux mécanismes.
Symptomatologie précoce du glaucome chronique à angle ouvert
Le glaucome chronique à angle ouvert présente un défi diagnostique majeur en raison de son caractère asymptomatique prolongé. Les manifestations précoces demeurent subtiles et souvent imperceptibles pour le patient, d’où l’importance cruciale du dépistage systématique. Comprendre ces signes précurseurs permet néanmoins d’orienter la suspicion diagnostique.
Scotomes paracentraux et altérations du champ visuel périphérique
Les premiers déficits du champ visuel apparaissent typiquement dans la région paracentralle, entre 10 et 20 degrés du point de fixation. Ces scotomes paracentraux correspondent à l’atteinte préférentielle des fibres nerveuses issues de la région maculaire périphérique. Initialement ponctuels et isolés, ces déficits s’étendent progressivement pour former des scotomes arciformes caractéristiques.
Le développement de ces altérations suit un pattern prévisible : les scotomes naissent souvent au niveau du faisceau papillomaculaire supérieur ou inférieur, puis s’étendent en arc de cercle autour du point de fixation. Cette progression explique pourquoi les patients conservent longtemps leur acuité visuelle centrale tout en perdant insidieusement leur vision périphérique. Le cerveau compense remarquablement ces déficits par des mécanismes de suppression et de comblement perceptuel.
Fluctuations de l’acuité visuelle et vision nocturne dégradée
Bien que l’acuité visuelle centrale reste préservée durant la majeure partie de l’évolution, certains patients rapportent des fluctuations discrètes de leur vision. Ces variations peuvent se manifester par une sensation intermittente de voile visuel, particulièrement perceptible lors d’activités nécessitant une discrimination fine des contrastes.
La vision nocturne se trouve précocement affectée dans le glaucome. Les patients décrivent souvent une difficulté accrue à s’adapter à l’obscurité et une gêne lors de la conduite nocturne. Cette symptomatologie s’explique par l’atteinte préférentielle des cellules ganglionnaires de type M, responsables de la détection des mouvements et de la vision en faible luminosité. La diminution de la sensibilité aux contrastes accompagne fréquemment ces troubles adaptatifs.
Céphalées orbitaires et sensation de pression oculaire
Contrairement aux idées reçues, le glaucome chronique peut occasionner des céphalées sourdes , localisées dans la région orbitaire et temporale. Ces douleurs, d’intensité modérée, surviennent typiquement en fin de journée ou lors d’efforts visuels soutenus. Bien que non spécifiques, ces céphalées méritent une attention particulière chez les patients présentant des facteurs de risque.
Certains patients décrivent également une sensation de pesanteur ou de pression au niveau des yeux, parfois accompagnée d’un larmoiement discret. Cette symptomatologie peut s’accentuer lors de variations brutales de la pression intraoculaire, notamment le matin au réveil ou lors de changements de position. Ces signes, bien que subjectifs, peuvent constituer des indices précieux pour le clinicien attentif.
Halos lumineux et éblouissement photophobique
L’apparition intermittente de halos colorés autour des sources lumineuses constitue un symptôme préoccupant, bien qu’inconstant dans le glaucome chronique. Ces phénomènes optiques résultent d’un œdème cornéen transitoire, secondaire aux élévations ponctuelles de la pression intraoculaire. Les halos apparaissent typiquement autour des éclairages artificiels, avec une prédominance des couleurs rouge et verte.
Un éblouissement anormal et une photophobie légère peuvent également accompagner les phases d’hypertonie oculaire modérée. Ces symptômes se manifestent particulièrement lors de l’exposition à des lumières vives ou lors du passage de l’obscurité à la lumière. Bien que discrets, ces signes doivent alerter, surtout s’ils s’associent à d’autres manifestations évocatrices du glaucome.
Manifestations cliniques du glaucome aigu par fermeture de l’angle
Le glaucome aigu par fermeture de l’angle présente une symptomatologie radicalement différente du glaucome chronique. Cette urgence ophtalmologique se caractérise par une élévation brutale et massive de la pression intraoculaire, déclenchant un tableau clinique spectaculaire et alarmant pour le patient.
Douleur oculaire intense et nausées réflexes
La douleur oculaire constitue le symptôme cardinal du glaucome aigu, d’intensité souvent décrite comme insoutenable par les patients. Cette algic présente des caractéristiques particulières : elle irradie typiquement vers la tempe et la région frontale homolatérale, évoquant parfois une migraine sévère. L’intensité douloureuse augmente progressivement, atteignant son paroxysme en quelques heures.
Les nausées et vomissements accompagnent fréquemment cette douleur, résultant d’un réflexe trigémino-vagal. Ces manifestations digestives peuvent égarer le diagnostic initial, faisant suspecter une pathologie gastro-intestinale. La prostration du patient et l’intolérance à la lumière complètent ce tableau clinique évocateur. Il s’agit véritablement d’une urgence médicale nécessitant une prise en charge immédiate pour préserver la fonction visuelle.
Mydriase aréflexique et œdème cornéen
L’examen ophtalmologique objective une mydriase caractéristique de l’œil atteint, avec une pupille dilatée et peu ou pas réactive à la stimulation lumineuse. Cette aréflexie pupillaire résulte de l’ischémie du muscle sphincter de l’iris, consécutive à l’hypertension intraoculaire majeure. La pupille adopte souvent une forme ovalaire, témoignant de l’atonie partielle du sphincter irien.
L’œdème cornéen accompagne systématiquement le glaucome aigu, conférant à la cornée un aspect dépoli et blanchâtre. Cet œdème épithélial et stromal résulte de la décompensation endothéliale face à l’élévation pressionnelle brutale. La perte de transparence cornéenne contribue à la baisse visuelle et génère les phénomènes de diffraction responsables des halos colorés perçus par le patient. L’œil apparaît globalement rouge et dur à la palpation.
Baisse brutale de l’acuité visuelle et vision colorée
La baisse d’acuité visuelle survient de manière brutale et progressive, pouvant évoluer de quelques dixièmes à la perception lumineuse en quelques heures. Cette détérioration rapide distingue nettement le glaucome aigu des formes chroniques. L’altération visuelle résulte de l’œdème cornéen, de l’ischémie rétinienne et de l’atteinte précoce du nerf optique.
Les patients décrivent fréquemment des distorsions visuelles et une perception anormale des couleurs. Les halos arc-en-ciel autour des sources lumineuses constituent un signe pathognomonique de l’œdème cornéen aigu. Ces phénomènes chromatiques peuvent précéder de plusieurs heures l’installation du tableau clinique complet, représentant un signal d’alarme crucial pour le diagnostic précoce. La vision peut devenir floue et déformée, avec une sensation de voile devant l’œil.
Hypertension intraoculaire supérieure à 40 mmhg
La mesure tonométrique confirme l’ hypertension intraoculaire majeure , avec des valeurs dépassant généralement 40 mmHg et pouvant atteindre 60 à 80 mmHg dans les formes sévères. Cette élévation pressionnelle contraste avec les valeurs normales de l’œil controlatéral, créant une asymétrie diagnostique évocatrice. La pression reste constamment élevée tant que persiste l’obstruction angulaire.
Cette hypertension massive compromet rapidement la perfusion du nerf optique et de la rétine, expliquant l’urgence thérapeutique. Chaque heure de retard dans la prise en charge augmente le risque de séquelles visuelles définitives. La correction pressionnelle doit être obtenue dans les premières heures pour préserver au maximum le potentiel visuel. L’évolution vers la cécité peut survenir en quelques heures en l’absence de traitement approprié.
Le glaucome aigu constitue l’une des rares urgences absolues en ophtalmologie, où chaque minute compte pour
préserver la fonction visuelle.
Techniques diagnostiques et examens paracliniques spécialisés
Le diagnostic du glaucome repose sur une approche multimodale combinant plusieurs examens complémentaires. Cette stratégie diagnostique permet une détection précoce et un suivi précis de l’évolution de la maladie. Chaque technique apporte des informations spécifiques sur différents aspects de la pathologie glaucomateuse.
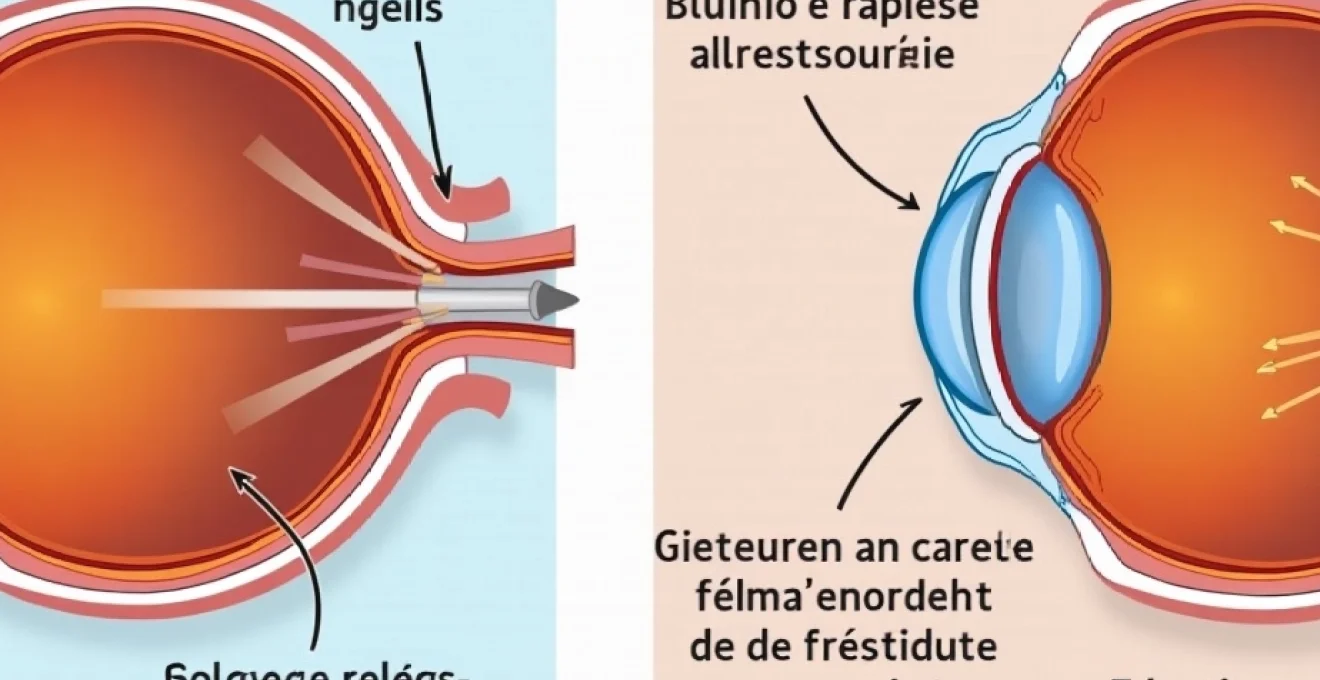
La tonométrie par aplanation de Goldmann demeure la référence pour la mesure de la pression intraoculaire. Cet examen, réalisé après anesthésie topique, permet une évaluation précise de la pression avec une marge d’erreur inférieure à 2 mmHg. Cependant, la mesure doit être interprétée en fonction de l’épaisseur cornéenne centrale, déterminée par pachymétrie ultrasonique. Les cornées épaisses surestiment la pression réelle, tandis que les cornées fines la sous-estiment, nécessitant des corrections mathématiques appropriées.
L’examen du fond d’œil et l’analyse de la papille optique constituent les piliers du diagnostic structural. L’ophtalmoscopie directe permet l’évaluation qualitative de l’excavation papillaire, mais l’imagerie moderne offre des analyses quantitatives plus précises. La tomographie par cohérence optique (OCT) mesure l’épaisseur des fibres nerveuses péripapillaires avec une résolution micrométrique, détectant des atteintes précliniques avant l’apparition des déficits campimetriques. Cette technologie révolutionnaire transforme l’approche diagnostique du glaucome.
La périmétrie automatisée explore la fonction visuelle et révèle les déficits du champ visuel caractéristiques du glaucome. Les algorithmes SITA (Swedish Interactive Threshold Algorithm) optimisent la durée d’examen tout en maintenant une sensibilité diagnostique élevée. L’interprétation des indices globaux (MD, PSD, VFI) et l’analyse topographique des déficits permettent de quantifier la sévérité et de suivre la progression de la maladie. La répétition des examens campimetriques s’avère indispensable pour confirmer la réalité des déficits et éliminer les artefacts.
La gonioscopie complète l’arsenal diagnostique en analysant l’angle iridocornéen. Cet examen, réalisé avec une lentille de contact spéciale, détermine le mécanisme physiopathologique et oriente la stratégie thérapeutique. L’évaluation de l’ouverture angulaire, de la pigmentation trabéculaire et des anomalies anatomiques guide la classification du glaucome et influence les choix thérapeutiques.
Populations à risque et facteurs prédisposants identifiés
L’identification des populations à risque constitue un enjeu majeur de santé publique pour optimiser les stratégies de dépistage. Les facteurs de risque du glaucome se répartissent en éléments non modifiables et en facteurs potentiellement influençables par des mesures préventives. Cette connaissance permet d’adapter la fréquence de surveillance et d’optimiser l’allocation des ressources de dépistage.
L’âge représente le facteur de risque principal non modifiable. La prévalence du glaucome augmente exponentiellement après 40 ans, passant de 0,5% dans la quatrième décennie à plus de 7% après 75 ans. Cette progression reflète le vieillissement naturel des structures oculaires et l’accumulation des facteurs de stress oxydatif. Les modifications liées à l’âge affectent particulièrement le trabéculum, dont l’efficacité filtrante diminue progressivement avec les années.
Les antécédents familiaux multiplient par 4 à 9 le risque de développer un glaucome, témoignant d’une composante génétique significative. Plus de 30 gènes ont été associés aux différentes formes de glaucome, avec des modes de transmission variables. La recherche génétique a identifié des mutations dans les gènes MYOC, OPTN et TBK1, particulièrement impliquées dans les formes précoces et sévères. Cette prédisposition génétique justifie un dépistage renforcé chez les apparentés de patients glaucomateux.
L’origine ethnique influence significativement l’incidence du glaucome. Les populations d’origine africaine présentent un risque 6 fois supérieur de développer un glaucome à angle ouvert, avec une tendance à des formes plus précoces et agressives. À l’inverse, les populations asiatiques montrent une prédisposition particulière aux glaucomes à angle fermé, en raison de caractéristiques anatomiques spécifiques comme la chambre antérieure peu profonde et la position plus antérieure du cristallin.
Les pathologies systémiques constituent des facteurs de risque modifiables importants. Le diabète sucré altère la microcirculation oculaire et favorise le développement de glaucomes néovasculaires. L’hypertension artérielle, paradoxalement, peut être protectrice en maintenant une perfusion adéquate du nerf optique, mais son traitement excessif peut créer une hypotension relative préjudiciable. Les apnées du sommeil, de plus en plus reconnues, perturbent l’autorégulation vasculaire oculaire et augmentent le risque glaucomateux.
La myopie forte (supérieure à -6 dioptries) s’associe à un risque accru de glaucome, particulièrement chez les sujets jeunes. Les modifications anatomiques de l’œil myope, incluant l’allongement axial et les déformations de la lame criblée, fragilisent le nerf optique face aux contraintes mécaniques. Cette association myopie-glaucome nécessite une surveillance rapprochée et des techniques diagnostiques adaptées aux particularités anatomiques de l’œil myope.
Protocoles de surveillance ophtalmologique et dépistage systématique
La mise en place de protocoles de surveillance rigoureux s’avère cruciale pour optimiser la détection précoce du glaucome. Ces programmes de dépistage systématique doivent être adaptés aux différentes populations cibles, en tenant compte des facteurs de risque individuels et des ressources disponibles. L’objectif consiste à identifier la maladie avant l’apparition de symptômes invalidants, permettant ainsi une prise en charge thérapeutique précoce.
Pour la population générale sans facteurs de risque particuliers, un dépistage opportuniste lors des consultations ophtalmologiques de routine s’avère approprié. La fréquence recommandée débute vers 40 ans avec un examen tous les 3 à 4 ans, puis s’intensifie après 60 ans avec une périodicité bisannuelle. Cette stratégie équilibrée permet de détecter la majorité des cas tout en maintenant un rapport coût-efficacité acceptable pour les systèmes de santé.
Les populations à risque élevé bénéficient d’un protocole de surveillance renforcé. Les apparentés de patients glaucomateux doivent débuter leur suivi dès 35 ans avec une fréquence annuelle. Les patients présentant une hypertonie oculaire isolée nécessitent un examen semestriel incluant une évaluation de la progression structurelle et fonctionnelle. Cette surveillance rapprochée permet d’identifier précocement la conversion vers un glaucome avéré et d’adapter rapidement la stratégie thérapeutique.
Le protocole d’examen de dépistage comprend systématiquement la mesure de la pression intraoculaire, l’évaluation de la papille optique et l’examen de l’angle iridocornéen par gonioscopie. L’imagerie par OCT des fibres nerveuses péripapillaires enrichit considérablement la sensibilité diagnostique, particulièrement chez les patients présentant une suspicion clinique. La périmétrie automatisée reste réservée aux cas suspects ou à la surveillance des patients déjà diagnostiqués, en raison de sa durée et de sa complexité technique.
L’innovation technologique transforme progressivement les approches de dépistage. Les tonométres portables et les dispositifs de télémédicine permettent d’étendre le dépistage vers des populations isolées ou difficiles d’accès. L’intelligence artificielle appliquée à l’analyse des photographies du fond d’œil montre des performances diagnostiques prometteuses, ouvrant la voie à des programmes de dépistage de masse automatisés. Ces outils technologiques nécessitent cependant une validation rigoureuse avant leur implémentation généralisée.
La coordination entre professionnels optimise l’efficacité des programmes de dépistage. Les médecins généralistes jouent un rôle pivot dans l’identification des patients à risque et leur orientation vers un spécialiste. Les orthoptistes peuvent réaliser certains examens de dépistage sous supervision médicale, augmentant la capacité diagnostique des centres spécialisés. Cette approche multidisciplinaire permet une meilleure couverture de la population et une utilisation optimale des compétences de chaque professionnel de santé.
Le suivi des patients diagnostiqués nécessite une surveillance prolongée et adaptée à la sévérité de la maladie. Les examens de contrôle incluent systématiquement la vérification de l’observance thérapeutique, l’évaluation de la tolérance du traitement et la recherche de signes de progression. La fréquence de surveillance varie de 3 à 6 mois selon la stabilité de la maladie et l’efficacité du traitement. Cette approche personnalisée permet d’optimiser les résultats thérapeutiques tout en minimisant le fardeau des examens pour les patients.